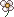les acides aminés
Une protéine, aussi appelée protide (anglicisme) est un assemblage (ou séquence) d'acides aminés liés par des liaisons peptidiques. On parle de protéine lorsque plus de 50 acides aminés sont liés au sein d'une chaîne d'acides aminés. Les propriétés des acides aminés (charge, hydrophobicité...) gouvernent la structure de la protéine, globulaire ou fibrillaire, que l'on peut décrire à différents niveaux :
• la structure primaire, qui est la séquence linéaire des acides aminés dans la protéine ;
• la structure secondaire, qui rend compte de l'organisation de groupes d'acides aminés en éléments structuraux simples : hélices alpha, feuillets et tours beta, autres structures ;
• la structure tertiaire, qui correspond au repliement de la protéine dans l'espace tridimensionnel (on parle aussi de structure tridimensionnelle décrite par les coordonnées des atomes dans l'espace). Cette structure rend compte de l'organisation entre eux des éléments de structure secondaire ;
• la structure quaternaire, qui définit l'association (multimérisation) entre des protéines de structures primaires identiques (homoassociation) ou distinctes (hétéroassociation).
Les protéines ont des fonctions très diverses : certaines pourront avoir une fonction structurale (elles participent à la cohésion structurale des cellules entre elles), enzymatique (elles catalysent les réactions chimiques de la matière vivante) ou encore une fonction de messager (pour les protéines impliquées dans des processus de signalisation cellulaire).
Les acides aminés
Les acides aminés sont formés d'un carbone auquel sont liés:
• Un groupement amine (NH2)
• Un groupement acide (COOH)
• Une portion variable d'un acide aminé à l'autre (indiqué par la lettre R sur la molécule ci-dessous; R pour radical).
Toutes les protéines (sauf rares exceptions) sont construites à partir de 20 acides aminés différents.
1. Les acides aminés hydrophobes à groupement R apolaire
• Alanine (Ala,A)
• Valine (Val,V)
• Leucine (Leu,L)
• Isoleucine( Ile,I)
• Méthionine (Met,M)
• Phénylalanine (Phe,F)
• Tryptophane (Trp,W)
• Proline (Pro,P)
2. Les acides aminés hydrophiles à groupement R polaire
• Glycine (Gly,G)
• Sérine (Ser,S)
• Thréonine (Thr,T)
• Cystéïne (Cys,C)
• Tyrosine (Tyr,Y)
• Asparagine (Asn,N)
• Glutamine (Gln,Q)
3. Les acides aminés à groupement R chargé négativement à pH neutre (aa Acides)
• Acide aspartique (Asp,D)
• Acide glutamique (Glu,E)
4. Les acides aminés à groupement R chargé positivement à pH neutre (aa Basiques)
• Lysine (Lys,K)
• Arginine (Arg,R)
• Histidine (His,H)
Stéréochimie des acides α-aminés
Les acides α-aminés naturels: sont tous chirals (et donc optiquement actifs), à l’exception de la glycine pour laquelle le substituant latéral est un atomed’hydrogène sont tous de configuration “L” selon la convention de Fischer ou “S” selon la notation de Cahn-Ingold-Prelog, à l’exception de la cystéine qui est de configuration “R”.
Pour chaque acide aminé, il existe une valeur spécifique du pH où la charge globale de la molécule est nulle. Cette valeur de pH représente le point isoélectrique où la concentration du zwitterion de l’acide aminé est maximale. Au point isoélectrique, il n’y a pas de migration de l’acide aminé dans un champ électrique appliqué.
Le point isoélectrique (pI) peut être estimé à partir de l’équation de Henderson-Hasselbalch:
où pKi et pKj sont les constantes de dissociation des étapes impliquées.
La liaison peptidique
Les acides aminés peuvent se lier les uns aux autres par une liaison peptidique. La liaison peptidique se fait entre le groupement acide (COOH) d'un acide aminé et le groupement amine (NH2) de l'autre. Au cours de la réaction, une molécule d'eau est éliminée. Il s'agit donc encore une fois d'une réaction de condensation.
L'union de plusieurs acides aminés forme un polypeptide.
Structure des protéines
Toutes les protéines sont formées d'une succession d'acides aminés liés les uns aux autres dans un ordre précis. Le lysozyme illustré ci-contre, par exemple, est formé de l'union de 129 acides aminés. Le premier est la lysine, le second, la valine, le troisième, la phénylalanine ... et le dernier, le 129e, la leucine. La séquence des acides aminés d'une protéine (quel acide aminé est le premier, le second, le troisième, ... , le dernier) constitue ce qu'on appelle la structure primaire de la protéine. Les radicaux des acides aminés ont des propriétés chimiques différentes. Certains sont hydrophobes, d'autres hydrophiles, certains s'ionisent négativement et d'autres positivement. Certains radicaux peuvent former des liaisons chimiques plus ou moins fortes avec d'autres radicaux. Il peut donc y avoir dans une chaîne d'acides aminés des interactions entre les radicaux. Certains se repoussent et d'autres se rapprochent et forment des liens chimiques. La chaîne d'acides aminés aura donc tendance à se replier sur elle-même pour adopter une structure tridimensionnelle précise.
Quatre grands types d'interactions interviennent dans le repliement de la chaîne:
• L'effet hydrophobe
Les acides aminés dont les radicaux sont hydrophobes ont plus d'affinité entre eux qu'avec les molécules d'eau entourant la protéine. La chaîne a donc tendance à se replier de façon à les regrouper entre eux au centre de la molécule, sans contact direct avec l'eau. Inversement, les acides aminés hydrophiles ont tendance à se disposer à la périphérie de façon à être en contact avec l'eau.
• Les liaisons ioniques
Les radicaux qui s'ionisent positivement forment des liaisons ioniques avec ceux qui s'ionisent négativement.
• Les liaisons hydrogène
• Les ponts disulfure
Deux des 20 acides aminés ont des radicaux contenant un atome de soufre. C'est le cas de la cystéine. Deux cystéines peuvent former une liaison covalente entre elles par l'intermédiaire de l'atome de soufre de leur radical. Cette liaison covalente peut relier deux cystéines éloignées l'une de l'autre sur la chaîne.
Certaines parties de la chaînes d'acides aminés adoptent une structure régulière appelée structure secondaire. On reconnaît deux grands types de structure secondaire : les hélices α et les feuillets plissés β résultent de la formation de ponts hydrogène entre les groupements C=O et N-H du squelette peptidique.
• L'hélice alpha
Cette forme hélicoïdale résulte de la formation de ponts hydrogène entre le groupement C=O du nième résidu d’aa et le groupement N-H de (n+4)ième résidu.
Chaque tour complet de la spirale est constitué d’environ 3.6 résidus d’acide aminé pour assurer l’alignement des groupements C=O (pointant vers le bas) et N-H (pontant vers le haut). Les groupements latéraux «R» sont orientés vers l’extérieur, perpendiculairement à l’axe de la spirale.
• Le feuillet bêta
Dans un feuillet bêta, il se forme des liaisons hydrogène entre certains segments de la chaîne disposés parallèlement les uns par rapport aux autres. L'ensemble forme comme une membrane plissée.
Dans un feuillet plissé β, deux chaînes peptidiques sont pliées et alignées l’une à côté de l’autre. Le repliement β des chaînes peptidiques est favorisé dans le cas d’acides aminés portant des petits groupement latéraux «R» non-chargés.
Les chaînes peptidiques sont maintenues par des ponts hydrogène.
Les groupements latéraux «R» sont
orientés vers l’extérieur, pointant vers le
haut et le bas de chaque feuillet.
Les chaînes adjacentes peuvent être
alignées, soient dans la même direction (plis parallèle β) ou dans des directions opposées (plis anti-parallèle β) .
Une protéine est donc faite d'hélices alpha et de feuillets bêta reliés par des segments qui n'ont pas de structure secondaire particulière.
La forme finale de la chaîne d'acides aminés, c'est à dire la structure tridimensionnelle (3D) finale qu'adopte la chaîne d'acides aminés, constitue la structure tertiaire de la protéine.
Elle inclut la relation entre les différents domaines (hélice α et feuillets plissés β) formés par la structure secondaire de la protéine et les interactions des groupements latéraux «R».
La structure 3-D est thermodynamiquement stable dans un domaine restreint de température, pH et force ionique. Au-delà de ce domaine une protéine peut se déplier et perdre sont activité biologique (dénaturation).
Structure quaternaire:
Une protéine peut être constituée de 2 ou plusieurs chaînes polypeptidiques différentes liées ensemble. La structure quaternaire décrit comment les différentes chaînes et autres constituants sont liés et interagissent ensemble via des ponts hydrogène, attraction
électrostatique et ponts disulfures.
Plusieurs protéines sont formées de l'assemblage de plusieurs chaînes d'acides aminés. C'est le cas, par exemple, de l'hémoglobine, la protéine des globules rouges qui transporte l'oxygène. L'hémoglobine est formée de deux chaînes dites alpha (identiques l'une à l'autre) et de deux chaînes dites bêta. On retrouve aussi, dans l'hémoglobine, quatre groupements organiques, appelés hèmes, contenant chacun un atome de fer (c'est à ce niveau que se lie l'oxygène